
17 December 2020
Introducción “Los microorganismos como elementos claves de la bioeconomía”
El crecimiento de la población mundial, el cambio climático y la necesidad de proteger el medioambiente son algunos de los desafíos a los que se enfrenta la humanidad. El futuro depende en gran medida de la accesibilidad a alimentos seguros, energía y agua.
Para proteger el acceso a estos recursos a medio y largo plazo, la producción y el consumo deben modificarse de forma que sean ecológica y socialmente sostenibles, premisas subyacentes al concepto de bioeconomía. Un aspecto inherente a este concepto reside en el uso eficiente de recursos biológicos, entendiéndose como tales cualquier material de origen biológico (biomasa), para la obtención de productos y servicios que generen un valor económico.
Las industrias biotecnológicas constituyen un nicho que provee de microorganismos (bacterias, levaduras, hongos filamentosos y microalgas) y sus productos a numerosos sectores, constituyendo uno de los pilares básicos para el desarrollo de la bioeconomía.
Esta actividad es unánimemente considerada en la Unión Europea como una de sus fortalezas tecnológicas y ha sido reconocida como «tecnología clave facilitadora» que ayudará a alcanzar una bioeconomía más competitiva y sostenible, contribuyendo a mejorar la calidad de los productos, incrementar su producción, proporcionar mayor resistencia a enfermedades (tanto humanas, como vegetales) u obtener mayor utilidad de los subproductos.
Las expectativas que ofrecen los microorganismos en este contexto aumentarán en un futuro con la aplicación de la genómica, proteómica y metabolómica que han contribuido significativamente a la explotación de la biodiversidad natural, también desde hábitats extremos.
Mediante la aplicación de tecnologías modernas, hoy en día es posible la utilización de enzimas microbianas muy potentes y estables, así como de sistemas microbianos robustos, y activos bajo condiciones de temperatura, pH o presión extremas.
Los productos y servicios que los microorganismos pueden proporcionar son múltiples en el contexto de la bioeconomía. En los siguientes apartados se describen algunas de sus aplicaciones más relevantes en los ámbitos de la agricultura, la salud humana, la industria y el medioambiente.
La bioeconomía es considerada en la Unión Europea como una de sus fortalezas tecnológicas «tecnología clave facilitadora»
Agricultura, microorganismos y economía circular
La agricultura intensiva se encuentra sometida a continuos avances que buscan el incremento de la productividad, entendida esta como aumento de la cantidad y calidad de los productos obtenidos, así como de la sostenibilidad, mediante el empleo de métodos y materiales más naturales y seguros de cara al consumidor.
Prueba de ello es el continuo desarrollo de mejoras en los sistemas y métodos agrícolas, tales como la utilización de estructuras más sostenibles que permiten:
- Reducir los consumos energéticos
- La mejora en el control climático de los invernaderos
- La reducción en el consumo de agua y fertilizantes
- O el desarrollo de métodos de lucha integrada y control biológico frente a agentes patógenos
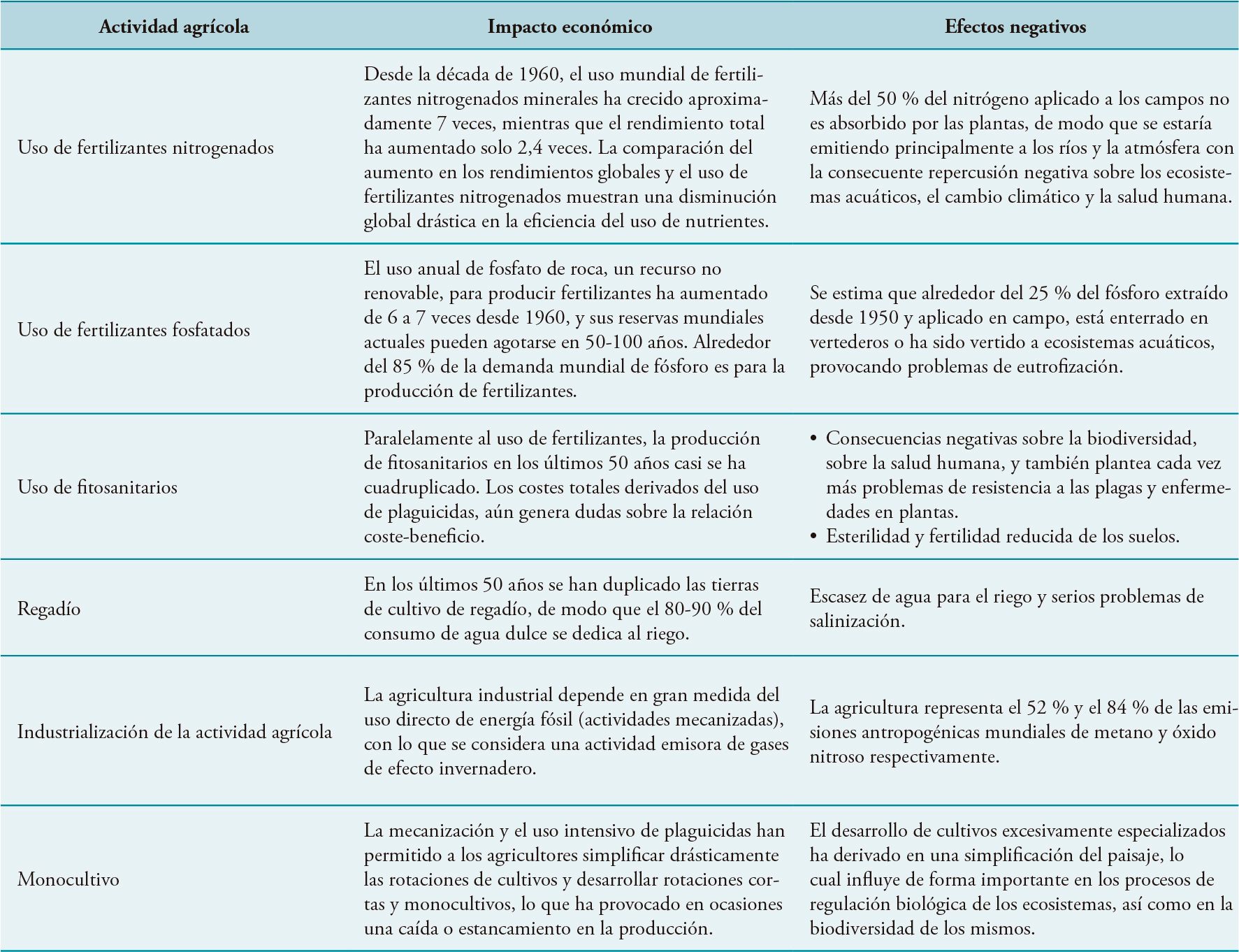
Algunas de las características más importantes de la agricultura intensiva y sus impactos negativos sobre el medioambiente, la seguridad alimentaria, y en definitiva la salud del consumidor, se indican en la Tabla 1.
La producción agrícola actual requiere de estrategias que reduzcan los insumos de agua, fertilizantes y fitosanitarios, para asegurar el rendimiento vegetal a un costo relativamente bajo, sin deterioro de la fertilidad del suelo. Una posible solución sería el uso de rizo-microorganismos, los cuales viven asociados a las raíces de las plantas, estimulando y facilitando, el sano desarrollo de las mismas a dosis inferiores de fertilizantes químicos.
Estos microorganismos son mayoritariamente bacterias, aunque también se incluyen destacadas especies fúngicas. Mediante su correcta aplicación es posible mejorar la absorción de fertilizantes, además de proteger a las raíces del ataque de fitopatógenos. Kloepper y Schroth fueron los primeros que definieron el grupo de bacterias promotoras de crecimiento vegetal o Plant Growth Promoting Rhizobacteria (PGPR).
Lo hicieron como «aquellas bacterias que al aplicarlas al suelo colonizaban las raíces de las plantas mejorando su crecimiento». Actualmente son aplicadas como inoculantes microbianos para potenciar los fenómenos de control biológico, o bien favorecer los procesos de biofertilización y fitoestimulación.
Tabla 1. Actividades agrícolas intensivas y su impacto negativo sobre el medioambiente y la salud de los consumidores
Dentro de los llamados PGPM (Plant Growth Promoting Microorganisms), si nos referimos en general a microorganismos de origen bacteriano y fúngico, se encuentran bacterias pertenecientes a los géneros Azotobacter, Acetobacter, Azospirillum, Burkholderia, Pseudomonas, Pasteuria y Bacillus, y hongos pertenecientes a los géneros Trichoderma, Peniclillium, Paecilomyces o Beauveria. Teniendo en cuenta que el estudio de este grupo microbiano se encuentra en auge, se propone para su mejor comprensión la separación en dos grupos, los agentes PGPM que afectan estrictamente al crecimiento vegetal, y los agentes «biocontrol-PGPM», término referido a aquellos que controlan el crecimiento de determinados agentes fitopatógenos. En general, se conocen dos mecanismos de estimulación del crecimiento vegetal por la inoculación con agentes biológicos, mecanismos indirectos y directos:
- Cuando la estimulación del crecimiento es indirecta, el agente microbiano libera algún metabolito, que a su vez, afecta a otros factores rizosféricos que revierten en una mejora o estimulación del crecimiento de la planta. Los mecanismos que estos agentes utilizan van desde la producción de sustancias movilizadoras de nutrientes, como ácidos orgánicos o aminoácidos, hasta la producción de sideróforos. También es muy común, dentro de este grupo, el control de patógenos mediante producción de sustancias antifúngicas o antibióticas, y mediante mecanismos de competencia por sustrato o inducción de la resistencia sistémica del vegetal. Estos mecanismos serían los típicamente utilizados por los agentes denominados «antagonistas». Por último, la hidrólisis de moléculas producidas por patógenos, la síntesis de enzimas hidrolíticas de la pared fúngica, la síntesis de ácido cianhídrico o el control de plagas producidas por insectos, son aspectos bien conocidos desde la década de los noventa.
- Por otro lado, los mecanismos directos son aquellos en los que el metabolito producido por el microorganismo es en sí capaz de estimular el crecimiento vegetal, y por tanto, no afectan en principio al resto de la población microbiana del suelo. De forma resumida, los mecanismos de acción directa son la fijación de nitrógeno asociada a la raíz (proceso exclusivo de algunos procariotas), nitrificación y amonificación, la producción de hormonas de tipo auxinas, citoquininas y giberelinas, la inhibición de la síntesis de etileno y el aumento de la permeabilidad de la raíz.
Biopesticidas
Para superar los peligros asociados al uso de plaguicidas químicos (Tabla 1), se está adoptando cada vez más el uso de productos derivados de fuentes naturales, de origen vegetal o microbiano. En los últimos años, numerosas empresas se han centrado en el desarrollo de productos considerados de «residuo cero», en los que no existe un período de seguridad entre la aplicación y el momento de la cosecha.
El término «biopesticida» engloba diversas estrategias de control, aunque en este capítulo nos centraremos en el uso de bacterias y hongos así como de una gran diversidad de metabolitos bioactivos producidos por ambos grupos microbianos, frente al desarrollo de enfermedades de plantas.
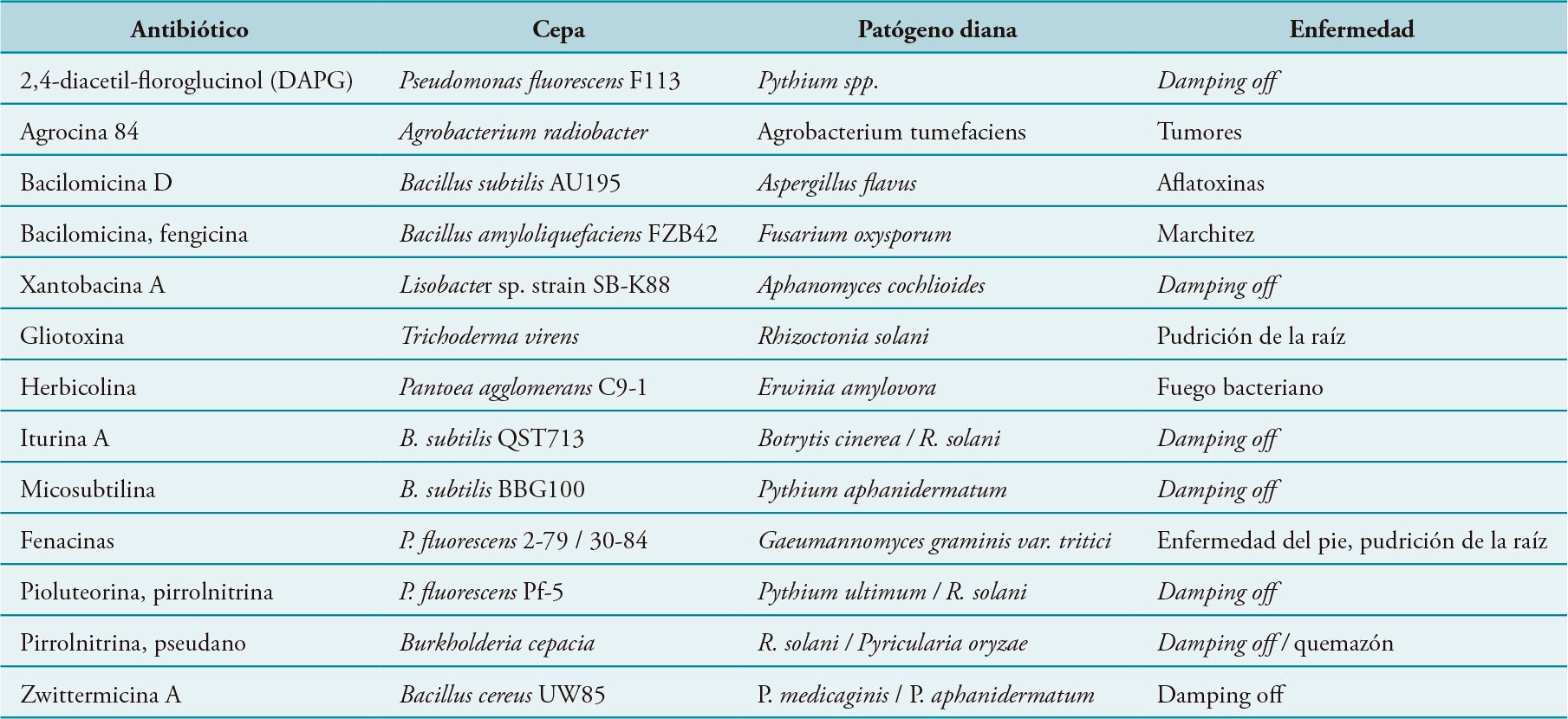
En la Tabla 2 se enumeran algunas de las sustancias antifúngicas y antibacterianas producidas por cepas bacterianas consideradas agentes de control biológico, y la enfermedad vegetal frente a la cual son efectivas.
Tabla 2. Antibióticos relevantes producidos por agentes de control biológico microbianos
Bioestimulantes y biofertilizantes
Existe cierta incertidumbre sobre el tipo de producto que puede considerarse bioestimulante o biofertilizante. Según el Consejo de Industria de Bioestimulantes (European Biostimulants Industry Council, EBIC), los bioestimulantes vegetales contienen sustancias y/o microorganismos cuya función en las plantas o la rizosfera es estimular los procesos naturales para mejorar la absorción de nutrientes, la tolerancia al estrés abiótico y la calidad de cultivo.
Los bioestimulantes no tienen acción directa contra las plagas y enfermedades y, por lo tanto, no entran dentro del marco regulatorio de los fitosanitarios. En el año 2011, se fundó el anteriormente mencionado EBIC que se encarga de promover la aplicación de este tipo de productos para mejorar el crecimiento y desarrollo vegetal a lo largo de todo el ciclo de cultivo.
Los mecanismos utilizados por este tipo de bioproductos son muy diversos, y van desde mejorar la eficiencia del metabolismo vegetal para inducir aumentos en el rendimiento y en la calidad del cultivo, a aumentar la tolerancia de la planta a los distintos estreses bióticos y abióticos, pasando por facilitar la asimilación, translocación y uso de nutrientes, mejorar los atributos de calidad de los productos, como el contenido de azúcar, color o textura, hacer que el uso del agua sea más eficiente o mejorar ciertas propiedades fisicoquímicas del suelo o fomentar el desarrollo de los microorganismos rizosféricos.
A diferencia de otros productos fertilizantes, en la Unión Europea los bioestimulantes carecen de normas que regulen su acceso al mercado. En este sentido, gracias en parte al trabajo desarrollado por el EBIC en lo últimos años, el Parlamento Europeo ha aprobado recientemente la necesidad de una regulación y desarrollo de un mercado único para esta innovadora industria de los bioestimulantes (enmienda adoptada por el Parlamento Europeo el 24 de octubre de 2017).
En el caso de los biofertilizantes, la situación es aún más complicada. No existe una definición oficial para este término, y en algunos casos los términos bioestimulantes y biofertilizantes se confunden. Sin embargo, se acepta que los biofertilizantes son mezclas complejas de origen biológico, como abonos o compost, obtenidos de transformaciones principalmente aeróbicas de la materia orgánica a partir de residuos vegetales. Debido a su origen, los biofertilizantes contienen niveles suficientes de nutrientes vegetales (nitrógeno, fósforo, potasio, calcio, magnesio) y microorganismos, que son capaces de producir el enriquecimiento en nutrientes del suelo, mejorando su disponibilidad para los cultivos.
En general, los bioestimulantes y biofertilizantes, se pueden agrupar en las siguientes categorías: microorganismos, ácidos húmicos y fúlvicos, extractos de algas marinas e hidrolizados de proteínas y aminoácidos. Cabe destacar el papel de las cianobacterias y las microalgas en el entorno de los agentes bioestimuladores del crecimiento vegetal. Este grupo está presente de forma natural en hábitats acuáticos dulces y salinos, y son una fuente rica de metabolitos biológicamente activos. Existen más de 30.000 especies de microalgas, pero las especies comercialmente más relevantes por su efecto bioestimulante son Chlorella, Spirulina y Scenedesmus.
El mercado global de biopesticidas y bioestimulantes
El mercado de los biofertilizantes y biopesticidas se diferencia en función del tipo de materia activa, de la variedad vegetal en la que se aplica o del método de aplicación. Algunos análisis de mercado publicados recientemente afirman que el valor de mercado global de fitosanitarios, suponía 1.700 millones de dólares en el año 2014 y experimentará un incremento en los próximos años superando los 4.200 millones de dólares en el año 2023. Por otro lado, en relación con el mercado de los biofertilizantes, se prevé que la tasa de crecimiento anual se incremente en más de un 13 %, alcanzando valores de 1.660 millones de dólares en este mismo año.
El mercado actual de biofertilizantes representa aproximadamente el 5 % del mercado total de fertilizantes químicos, destacando la comercialización de organismos fijadores de nitrógeno. Entre los bioproductos de mayor interés destacan aquellos preparados a base de cepas de Rhizobium, Actinorhizobium, Azotobacter y Azospirillum, utilizándose principalmente para el cultivo de leguminosas, arroz y caña de azúcar.
Aunque el pronóstico es que el mercado norteamericano domine la venta de productos de carácter biopesticida y biofertilizante durante la próxima década, es posible que en Europa se observe un importante incremento en la aplicación de este tipo de productos, dadas las exigencias de los consumidores en lo referente a productos ecológicos, libres de fitosanitarios químicos. Actualmente, en esta zona geográfica, el precio de los bioplaguicidas microbianos es, al menos, un 25 % mayor que el de los fitosanitarios convencionales. Incluso se espera que esta diferencia se haga mayor gracias a la reducción en los precios de los fitosanitarios convencionales. Además, la aplicación de nuevas tecnologías y la mejora del sector servicios, podría provocar un incremento inmediato de los precios de este tipo de productos, aunque el pronóstico es que tiendan a estabilizarse a corto-medio plazo.
Bioeconomía y salud humana
En sanidad, los productos o actividades de base biotecnológica más relevante son los denominados biofármacos, las terapias experimentales (como la ingeniería celular y tisular y la terapia génica), el diagnóstico, la bioinformática (incluyendo la secuenciación de DNA y la farmacogenómica), los alimentos funcionales y nutracéuticos y los productos sanitarios.
Los biofármacos o biomedicamentos generados gracias a los grandes avances en biología molecular son, sin duda, la causa principal de crecimiento de la industria farmacéutica de los últimos treinta años. A finales del año 2014, se aprobaron 260 nuevos productos dirigidos al tratamiento de más de 230 indicaciones diferentes. Ya en ese momento, las ventas totales acumuladas de biofármacos superaban los 140.000 millones de dólares.
La mayoría de los productos biotecnológicos tradicionales poseen valores de mercado más modestos que aquellos generados gracias a la tecnología del ADN recombinante. Dicha tecnología permite la modificación de biomoléculas complejas, y se ha aplicado en la industria farmacéutica desde la década de los setenta. Algunos de los productos que han supuesto una revolución en la industria sanitaria y en consecuencia, en la salud y calidad de vida, son las nuevas generaciones de insulina humana, las innovadoras terapias contra el cáncer basadas en anticuerpos, los interferones para el tratamiento de infecciones virales y una variedad de terapias para enfermedades no transmisibles como la esclerosis múltiple o la artritis reumatoide.
Un biofármaco se puede definir como cualquier producto obtenido a partir de un ser vivo o material biológico mediante un proceso biotecnológico y que se utiliza con fines terapéuticos y de diagnóstico. El origen de este tipo de productos biológicos puede ser microbiano o bien a partir de órganos y tejidos de origen vegetal o animal, y células o fluidos de origen animal (incluidos los de origen humano). Dentro del gran grupo de los biofármacos, las categorías más importantes son proteínas recombinantes, anticuerpos monoclonales, vectores de material genético, fragmentos de anticuerpos, oligonucleótidos y vacunas.
Tanto las proteínas recombinantes como los anticuerpos monoclonales, son producidos a partir de sistemas biológicos vivos (bacterias, hongos, levaduras, células de mamíferos, tejidos de origen vegetal o animal, animales de laboratorio). El proceso completo incluye técnicas de ingeniería genética dirigidas en primer lugar a la clonación de una secuencia genética dentro de un vector de expresión apropiado (viral o plasmídico, principalmente), seguido por la construcción de un sistema de expresión celular (procariota o eucariota) y, finalmente, el diseño de un sistema de producción industrial a gran escala (upstream). Una vez realizado el diseño de producción, la proteína deseada debe ser aislada y purificada utilizando técnicas que no alteren su estructura e integridad funcional (downstream). Finalmente, el producto purificado debe ser formulado adecuadamente para no perder actividad biológica antes de ser administrado en pacientes.
Biofármacos producidos por microorganismos
El uso de biomedicamentos en salud humana data del siglo XIX, con el uso de la conocida antitoxina diftérica. Dicha práctica consistía básicamente en el uso de inmunoglobulinas extraídas del suero de animales inmunizados, que reconocían y neutralizaban la toxina. Este método se ha utilizado tradicionalmente durante décadas para combatir el envenenamiento por serpientes, escorpiones y avispas. Sin embargo, el uso de anticuerpos de origen no humano, puede causar graves reacciones de hipersensibilidad en el paciente. Ya en el siglo XX, fue muy útil el empleo de moléculas procedentes de fuentes animales, como la insulina, la hormona del crecimiento (GH) o el glucagón, aunque el descubrimiento de las enfermedades priónicas relacionadas con la administración de la hormona del crecimiento, reveló otro potencial riesgo asociado con proteínas animales no humanas. Este hecho reforzó la necesidad de producir biofármacos proteicos a partir de otras fuentes más seguras, y aquí es donde los microorganismos y la tecnología del ADN recombinante, han jugado un papel especial en los últimos cuarenta años.
El uso de células microbianas recombinantes ha permitido la producción a gran escala de un gran número de productos de interés farmacéutico (hormonas, anticoagulantes, proteínas de alto valor, anticuerpos y antígenos, interferones o interleucinas, entre otros). Los principales microorganismos explotados como «biofábricas» son la especie bacteriana Escherichia coli, seguida de la levadura Saccharomyces cerevisiae.
Aproximadamente el 30 % de las proteínas recombinantes disponibles comercialmente actualmente se producen en sistemas procariotas. Hoy en día es posible sintetizar cerca de 2.000 productos en E. coli (bioproductos no nativos), de los cuales 279 tienen aplicaciones comerciales. No solo esta especie, sino también algunas cepas modificadas de Staphylococcus carnosus, Corynebacterium glutamicum, Bacillus subtilis y Lactococcus lactis, por ejemplo, se han utilizado en la síntesis biológica de calcitonina, aminoácidos (glutamato y lisina) o proinsulina, entre otros.
Por otro lado, además de la levadura S. cerevisiae, la utilización de hongos filamentosos como fábricas eucariotas de biofármacos, justifica el potencial de este grupo microbiano para ser utilizado con dicha finalidad. En particular, el aislamiento e identificación de hongos endófitos productores de taxol, un fármaco antineoplásico, ha avanzado significativamente en las últimas décadas. Se ha podido sobreproducir taxol a partir de algunas cepas de Fusarium oxysporum, Aspergillus niger y Taxomyces andreanae, entre otras. También se ha avanzado en la producción de determinadas enzimas extracelulares a partir de hongos filamentosos, como es el caso de la β-D-galactosidasa, producida por algunas cepas de Aspergillus foetidus, responsable de la catálisis de lactosa a glucosa y galactosa, y que ha sido fundamental en el tratamiento de la intolerancia a la lactosa, así como en el desarrollo de alimentos funcionales, o como aditivo en productos lácteos fermentados, panes y bebidas.
Otros biofármacos de origen fúngico que merecen especial atención son la enzima asparraginasa, producida por algunas cepas de Aspergillus terreus, muy útil en el tratamiento de determinados tipos de linfoma, o determinadas proteasas con actividad colagenolítica producidas por cepas de A. niger, así como la producción de interleucinas a partir de cepas recombinantes de A. nidulans.
El mercado de los biofármacos
La producción de proteínas recombinantes es una de las aportaciones más importantes de la biotecnología moderna, lo que ha supuesto además un enorme impacto económico en el sector de la salud humana. De hecho, se estima que en los próximos diez años, más del 50 % del mercado de los biofármacos podría estar dedicado a la obtención de proteínas recombinantes.
Las ventas actuales en el mercado de los biofármacos recombinantes de origen microbiano superan los 50.000 millones de dólares, lo que representa un tercio de las ventas totales de productos biofarmacéuticos.
En el año 2015, al menos diez fármacos de origen biotecnológico figuraban ya entre los veinticinco medicamentos más vendidos. Cuatro de ellos eran producidos por microorganismos, en concreto por algunas cepas de las especies E. coli, Streptococcus pneumoniae y Corynebacterium diphtheriae, alcanzando un volumen de ventas en torno a los 22.000 millones de dólares.
Los microorganismos en la industria
Las aplicaciones de los microorganismos y sus productos en el ámbito industrial abarcan casi todos los sectores. En este apartado nos centraremos en tres tipos de productos que presentan un amplio número de aplicaciones: las enzimas microbianas como elementos catalizadores de diversos procesos, los ácidos orgánicos y biopolímeros por su aplicación emergente en química verde y en producción de nuevos materiales, y la producción de bioenergía y biocombustibles, que contribuirá a la demanda energética renovable actual. También se describe el concepto de biorefinería como elemento integrador de las nuevas tendencias en los procesos industriales y se destacan algunos aspectos relevantes sobre el mercado de dichos productos microbianos.
Enzimas microbianas
Diversas bacterias y hongos producen enzimas que presentan numerosas aplicaciones en áreas tales como agricultura, industria química, agroalimentaria, textil, farmacéutica, papelera, analítica, detergentes, cosmética y en control de la contaminación. Entre las enzimas actualmente comercializadas, el 50 % son producidas por hongos y el 35 % por bacterias. El número de enzimas microbianas descritas asciende a unas 4000 y los microorganismos productores son muy diversos, destacando por volumen actual de producción la bacteria Bacillus subtilis y el hongo Aspergillus oryzae.
Alrededor de 150 procesos industriales emplean enzimas microbianas y unos 500 productos industriales se fabrican mediante su uso. La industria de procesado de alimentos y bebidas representa el principal campo de aplicación actual, seguida de la producción de detergentes, pero la demanda aumentará como consecuencia de la búsqueda de soluciones sostenibles en procesos de transformación establecidos y a la creación de nuevos procesos y productos. A modo de ejemplo, en la Tabla 3 se muestran las principales enzimas empleadas por diversas industrias.
Tabla 3. Principales enzimas microbianas con aplicación industrial
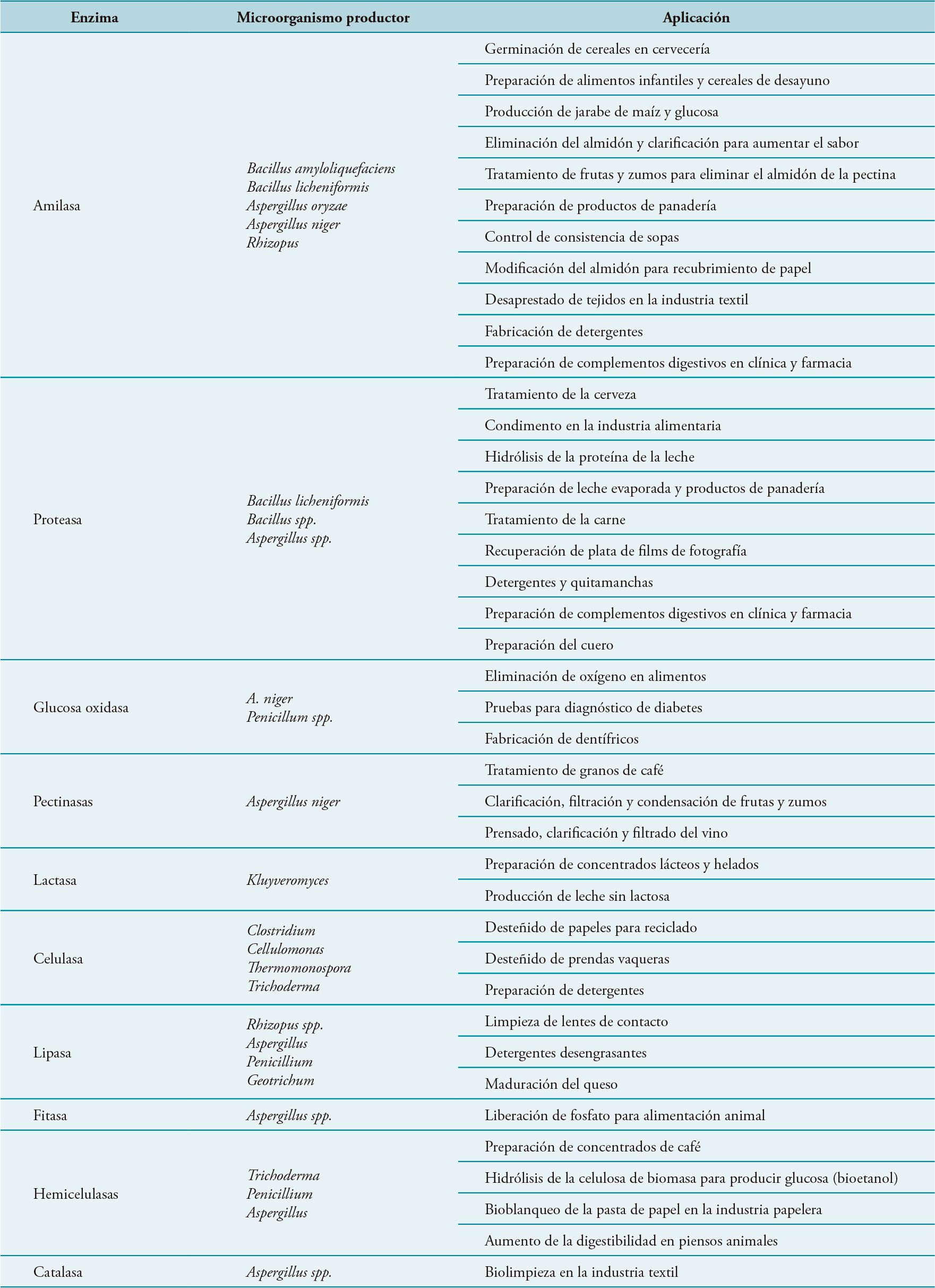
Las enzimas empleadas para la fabricación de piensos se incorporan para incrementar su digestibilidad y reducir el impacto ambiental ocasionado por las heces animales. Las enzimas técnicas incluyen un amplio grupo de enzimas que se aplican en industrias tan diversas como la química, textil, producción de cuero, papel y biocombustibles. Estas aplicaciones constituyen un campo emergente. En el futuro próximo y como consecuencia de las nuevas tendencias en el ámbito de la bioeconomía sostenible, se espera un incremento notable de las enzimas en aplicaciones tales como la producción de papel, biocombustibles, caucho, fotografía, detergentes biológicos, limpiadores de lentes de contacto y biología molecular.
Biocompuestos y biopolímeros: nuevos materiales
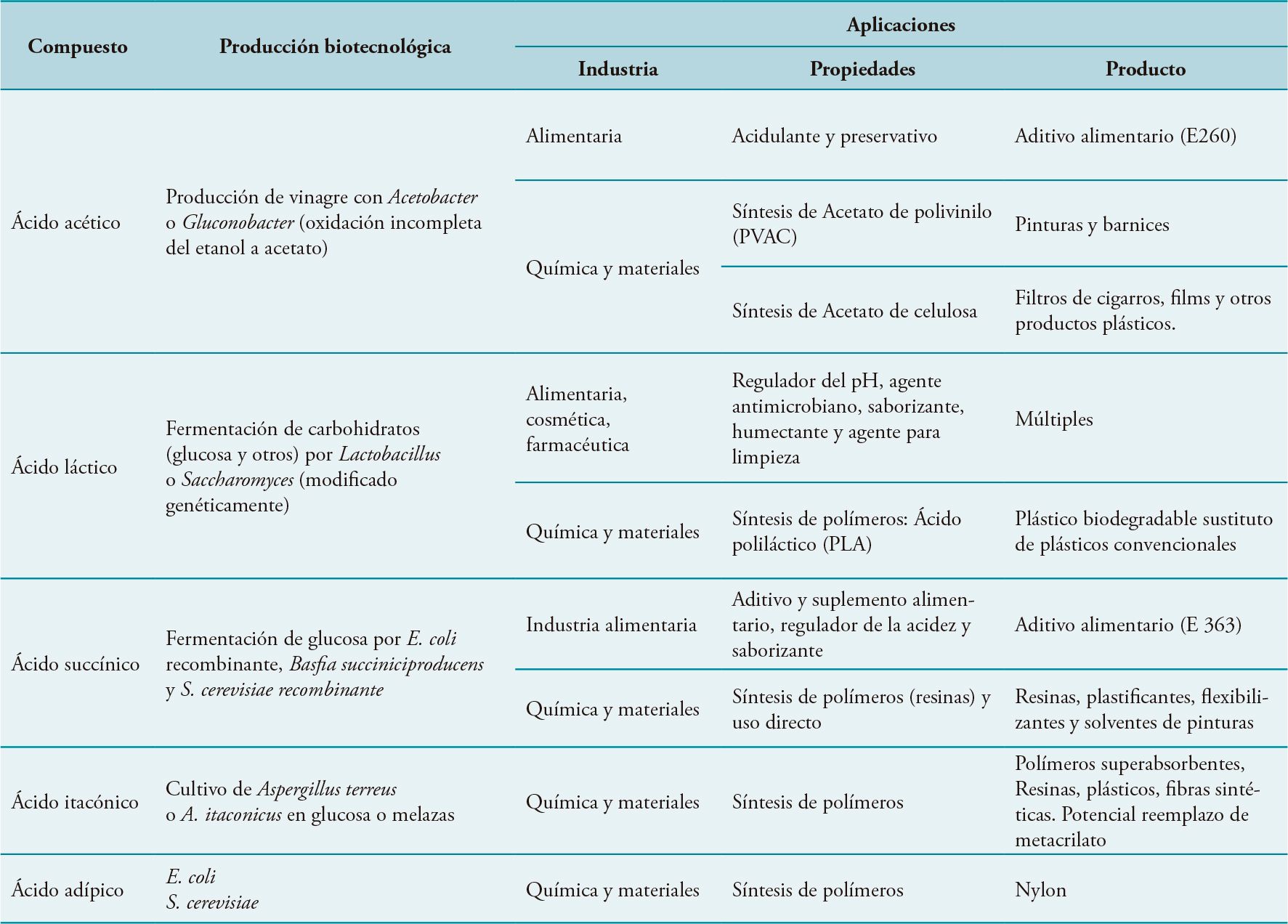
Los ácidos orgánicos son compuestos base para la síntesis química y sirven para la producción de polímeros (bioplásticos y otros biopolímeros), entre otros. La mayoría de ellos se obtienen a partir del petróleo, pero la tendencia actual es sustituirlos por otros procedentes de recursos renovables. Actualmente, los ácidos orgánicos más importantes en cuanto a volumen de producción son los ácidos acético, láctico, itacónico, succínico y cítrico. Los microorganismos y sus enzimas, se han constituido como elementos clave en la producción de estos compuestos y de otros que permiten la creación de nuevos procesos de síntesis. En la Tabla 4 se muestran las alternativas biotecnológicas para la producción de los ácidos orgánicos con mayor potencial así como sus principales aplicaciones.
Entre los biopolímeros empleados como plásticos destacan los polihidroxialcanoatos (PHA) que son polímeros sintetizados y acumulados como material de reserva por los microorganismos procariotas. El primer PHA se descubrió en 1926 en Bacillus megaterium y posteriormente se ha detectado en más de noventa especies de bacterias, incluyendo Cupriavidus necator, que tiene actualmente una elevada proyección. Estos polímeros son biodegradables y se emplean para la fabricación de envases, productos de uso doméstico, cosmética y material de medicina. También se pueden fabricar a partir del ácido poliláctico (PLA), un material biodegradable que se obtiene a partir del ácido láctico producido por bacterias mediante fermentación de azúcares (Tabla 4). Adicionalmente existen otras alternativas biotecnológicas para la obtención de materiales. Así, por ejemplo la compañía BASF ha producido un intermediario de síntesis del nylon empleando Corynebacterium glutamicum. Por su parte, las compañías DuPont y Goodyear están trabajando con cepas de E. coli modificadas genéticamente que son capaces de producir isopreno (bioisopreno), un intermediario químico empleado en la síntesis del caucho que se puede utilizar en la producción de neumáticos «verdes».
Tabla 4. Producción microbiana de ácidos orgánicos relevantes en producción de nuevos materiales
Bioenergía y biocombustibles
El término biocombustible se aplica a combustibles renovables obtenidos a partir de biomasa mediante procesos químicos o bioquímicos. El biocombustible microbiano de mayor proyección es el bioetanol, pero a él se unen otros biocombustibles líquidos como el butanol y el 2,3 butanodiol. Adicionalmente otros productos microbianos tales como el metano, el hidrógeno o el biohitano (mezcla de metano e hidrógeno) constituyen fuentes notables de bioenergía. Finalmente, los microorganismos capaces de transferir electrones extracelularmente se incorporan en los sistemas denominados «Microbial Fuel Cells» (MFC) que permiten la producción directa de electricidad (bioelectrogénesis).
El bioetanol de segunda generación se produce en dos fases. La primera está orientada a liberar los azúcares contenidos en la biomasa. En la segunda dichos azúcares son fermentados por microorganismos productores. En el caso del bioetanol se emplea la levadura S. cerevisiae y otros microorganismos como Zymomonas mobilis capaces de fermentar un mayor rango de carbohidratos. Este modelo se aplica también para la producción de biobutanol mediante fermentación ABE (acetona-butano-etanol) por especies del género Clostridium.
La producción biológica de metano se realiza mediante la digestión anaerobia de residuos orgánicos que genera un gas rico en metano denominado biogás. Este gas puede utilizarse como combustible para generar energía eléctrica, mecánica o calorífica. Adicionalmente se obtiene una fracción sólida que puede ser utilizada como sustrato orgánico en agricultura, preferentemente tras ser sometida a compostaje. La digestión anaerobia está actualmente implantada como método de tratamiento y aprovechamiento energético de diversos residuos. Modulando sus condiciones de operación es posible también producir hidrógeno o biohitano, que presenta unas mejores prestaciones para automoción que cada uno de sus dos componentes. Otros procesos microbianos para la producción de hidrógeno incluyen la fotofermentación y la biofotolisis.
La producción de bioelectricidad es realizada en reactores MFC que contienen dos cámaras con electrodos, un ánodo y un cátodo, separadas por una membrana. Estas MFC se alimentan con residuos orgánicos (aguas residuales urbanas o industriales) y permiten el crecimiento de microorganismos electrogénicos. Estos sistemas pueden emplearse como acumuladores energéticos (pilas biológicas), para el tratamiento de aguas, la recuperación de metales valiosos y la producción de electricidad.
Biorefinerías
El término biorefinería alude a procesos sostenibles de transformación de la biomasa, generalmente en cascada, que generan diversos productos comercializables y energía. La secuencia en este concepto implica el empleo en primera instancia de materias primas procedentes de plantas, animales o pesca para la producción de alimentos y productos farmacéuticos de forma segura. Los residuos o subproductos generados en dichas transformaciones son empleados para la alimentación de ganado, la producción de nuevos materiales o la obtención de productos biotecnológicos (microorganismos, enzimas, etc.) y compuestos químicos. Finalmente, los residuos procedentes de tales transformaciones o no susceptibles a las mismas se emplean para la producción de energía y compost. En una biorefinería los microorganismos y sus productos y transformaciones constituyen una de las piedras angulares. Una biorefinería puede dar lugar a biocombustibles (bioetanol, hidrógeno, metano o biohitano), compuestos químicos de base (azúcares, ácidos orgánicos, bioetanol, biobutanol), bioelectricidad, biomasa microbiana, biopolímeros, biofertilizantes, alimento animal, a la vez que se minimiza la generación de residuos. La implementación de estos modelos contribuirá al desarrollo de una bioeconomía basada en el uso sostenible de recursos.
Mercado de productos microbianos industriales
El mercado global de enzimas alcanzó los 8.000 millones de dólares en el año 2015 y experimenta un continuo aumento debido a su creciente número de aplicaciones en la producción de detergentes, productos farmacéuticos y alimentos y bebidas. Actualmente, se comercializan aproximadamente 200 tipos de enzimas de las 4000 conocidas, pero solo unas 20 se producen a escala verdaderamente industrial. Alrededor del 75 % del total de enzimas es producido por tres compañías: Novozymes, DuPont y Roche.
El mercado de los biopolímeros está dominado por el PLA. Su producción mundial se ha duplicado entre los años 2011 y 2015 alcanzando las 400.000 t por año. El ácido succínico se encuentra entre los 12 compuestos químicos de base con mayor proyección, la producción total anual es de 30.000 a 50.000 t y se espera que su mercado aumente para 2020 a 654.000 t. En el ámbito de las biorefinerías, en la Unión Europea existe potencial para valorizar alrededor de 100 Mt de biomasa sin impactar adversamente el medioambiente o la producción de alimentos. El aprovechamiento de dicha biomasa en biorefinerías conduciría a reducir las emisiones de CO2 en más de 60 Mt, cantidad equivalente a las emisiones anuales de ciudades europeas como Paris o Londres.
Aplicaciones de los microorganismos en el medioambiente
La aplicación de la biotecnología para la protección del medioambiente es intrínseca a la filosofía de la bioeconomía sostenible. Los procesos biotecnológicos son de forma inherente más limpios que los petroquímicos, se desarrollan en un ambiente controlado y tienen el potencial de producir mayores rendimientos de productos específicos con menor demanda energética y mínima generación de residuos. Como consecuencia de todo ello tienen un reducido impacto ambiental. En el contexto de la protección del medioambiente también deben considerarse otros procesos mediados por microorganismos que se enmarcan como elementos de la bioeconomía. Tal es el caso del uso de microorganismos en descontaminación ambiental (suelo, agua y aire) o en el secuestro de CO2 para mitigar el cambio climático.
Biodescontaminación
La biodescontaminación o biorremediación consiste en el uso de plantas, microorganismos o sus productos para limpiar entornos contaminados (agua, gases o sólidos). A diferencia de otros productos o servicios resultantes de la industria biotecnológica, su éxito reside más en el cumplimiento de normativas que en el beneficio económico de su producción.
Para la descontaminación de suelos se emplean microorganismos para la biodegradación de hidrocarburos, metales pesados, residuos de fitosanitarios y otros contaminantes ambientales. Estos procesos se llevan a cabo en tierras o materiales contaminados bien estimulando la acción de los microorganismos presentes en los mismos (bioestimulación) mediante incorporación de materia orgánica u operaciones de aireación, o por incorporación de microorganismos con reconocida capacidad para ello (bioaumentación) proporcionados por la industria biotecnológica.
Aunque se puede considerar que la descontaminación de suelos y efluentes industriales permite el retorno de recursos y servicios, la implementación de procesos que permitan recuperar los recursos contenidos en efluentes contaminados conducirá a ofrecer una nueva dimensión en el ámbito de la bioeconomía para estos flujos. Así por ejemplo, el tratamiento convencional de aguas residuales ha estado orientado a eliminar su carga contaminante. Este enfoque está cambiando de modo que se han propuesto nuevos modelos para recuperar los recursos contenidos en dichos efluentes, incluyendo procesos de extracción biológica de componentes tales como nitrógeno y fósforo para su uso posterior en agricultura, así como el tratamiento de materiales sólidos de depuradora (fangos) mediante digestión anaerobia para producción de biogás, y la producción de compost a partir de los sólidos obtenidos tras dicho proceso. De este modo las depuradoras podrán en un futuro ser consideradas como suministradoras de energía, productos con valor y agua descontaminada.
Mitigación del cambio climático: secuestro de CO2
El cambio climático sin precedentes influenciado por las elevadas concentraciones de, entre otros gases, CO2, ha estimulado la búsqueda de alternativas para el secuestro de este gas. En este sentido, se han desarrollado diversas estrategias que proponen el uso de microorganismos que asimilan CO2 y sintetizan productos con valor añadido que pueden estimular la bioeconomía circular. Aunque las plantas y las algas son bien conocidas para tal actividad, el CO2 puede ser también asimilado por bacterias fotosintéticas aerobias (cianobacterias) y anaerobias, así como por bacterias no fotosintéticas. Estos microorganismos pueden ser modificados genéticamente para incrementar su capacidad para fijar CO2, lo que unido al uso de efluentes industriales para el cultivo de los microorganismos proporcionará una nueva dimensión a este modelo que podrá ser explotado en el contexto de las biorefinerías.



